最近の研究(2)
生体内におけるDNA分解の必要性 その2 ー DLADノックアウトマウスの解析から
DNase IIはほぼ全ての細胞に発現しているが、例外的に目の水晶体には発現していない。しかしながら、水晶体はその透明性を維持するために分化の過程で自身の細胞を自ら分解することが知られている。DNase IIでないのならば水晶体の核分解を担うDNA分解酵素は何だろうか?
DLADノックアウトマウスの作成
私たちは、DNase IIと相同性を持つ酸性DNA分解酵素ーDLAD (DNase II-like acid DNase)ーが水晶体に特異的に発現していることを突き止めた。
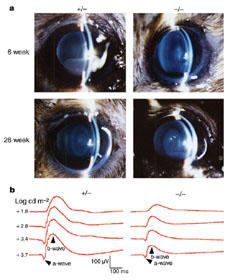
DLADノックアウトマウスは一見正常に発生したが、目の水晶体には本来除去されるはずのDNAが分解されずに残っていた。このマウスは加齢に伴って白濁が見られ、白内障の症状を呈すことが分かった。すなわち、水晶体ではDLADが核DNAのが除去に必須の役割を果たしており、DNAが適切に除去されないと水晶体で光が散乱し、視力に障害を及ぼすことが明らかとなった。
マクロファージによるアポトーシス細胞の貪食機構
マクロファージはアポトーシス細胞を貪食するが、生きている細胞を貪食することはない。これは、アポトーシス細胞が細胞表面に、"eat me" シグナルと呼ばれる一連の分子を細胞膜上に露出し、これをマクロファージが認識し貪食しているためだと考えられている。
私たちはマクロファージ上のeat meシグナル認識分子を同定するために、アポトーシス細胞の貪食を定量的に評価する系を樹立した。次いで、マクロファージをハムスターに免疫することでマクロファージに対する抗体を作成し、アポトーシス細胞の貪食を阻害する抗体をスクリーニングした。
1) MFG-E8の発見
マクロファージとしてチオグリコレートで誘導した腹腔内マクロファージをハムスターに免疫し、スクリーニングしたところMFG-E8というタンパク質を同定した。MFG-E8は分泌タンパク質であり、マクロファージ上に発現するインテグリンと、アポトーシス細胞上に提示されるホスファチジルセリンの両方に結合し、二つの細胞を橋渡しをしている。本来アポトーシス細胞を貪食しないようなマウスの繊維芽細胞 (NIH3T3) にMFG-E8を加えると、アポトーシス細胞を効率良く貪食するようになるため、MFG-E8は効率的な貪食機構に欠かせない分子であると考えられる。
それでは、マクロファージが効率よくアポトーシス細胞を貪食できないとどうなるのだろうか?この疑問を解決するためにMFG-E8のノックアウトマウスを作成した。
2) MFG-E8ノックアウトマウスの解析

MFG-E8ノックアウトマウス(右図)では野生型マウス(左図)と比較して脾臓が顕著に肥大しており、B細胞が存在する領域である胚中心が異常に大きいことがわかった。
MFG-E8は、脾臓に存在するマクロファージのひとつであるtingible body macrophageに特異的に発現しており、このマクロファージはアポトーシスを起こしたB細胞を専門に貪食することが知られている。
MFG-E8欠損マウスでは脾臓・胚中心におけるアポトーシスB細胞の除去が障害されているために、巨大な脾臓・胚中心となると考えられる。
さらに、MFG-E8ノックアウトマウスは自己免疫疾患を発症すことから、アポトーシス細胞が適切に除去することは、自己免疫疾患を防ぐうえで重要であることが明らかとなった。
3) TIM4の発見
MFG-E8はチオグリコレートで誘導した腹腔内マクロファージから分泌される。しかしながら、非炎症下の腹腔内在住マクロファージには発現していないが、アポトーシス細胞を効率よく貪食する。
そこで、MFG-E8とは異なるeat meシグナル認識分子が同定できると考え、腹腔内在住マクロファージをハムスターに免疫し、スクリーニングしたところTIM-4というタンパク質が同定された。
MFG-E8は分泌タンパク質であるが、TIM4はマクロファージ上に発現していることからホスファチジルセリン受容体であると考えられた。TIM4もMFG-E8同様にNIH3T3に強制発現させると、NIH3T3はアポトーシス細胞を効率良く貪食できるようになる。
